III. RADIACIÓN SOLAR, APLICACIONES DE LA RADIACIÓN, CAPA PROTECTORA DE OZONO, FOTOSÍNTESIS, ATMÓSFERA OXIDANTE, CONDICIONES APROPIADAS PARA LA VIDA ANIMAL
EN EL Sol se están generando constantemente grandes cantidades de energía mediante reacciones termonucleares. La energía radiante se propaga por el espacio viajando a razón de 300 000 km por segundo (velocidad de la luz, c). A esta velocidad, las radiaciones llegan a la Tierra ocho minutos después de ser generadas.
Las distintas radiaciones solares, de las cuales la luz visible es sólo una pequeña parte, viajan por el espacio en todas las direcciones, como los radios de un círculo, de donde proviene su nombre.
Debido a que las radiaciones viajan como ondas a la velocidad de la luz (c),
tendrán como característica la longitud de onda (l),
que es la distancia entre dos máximos.
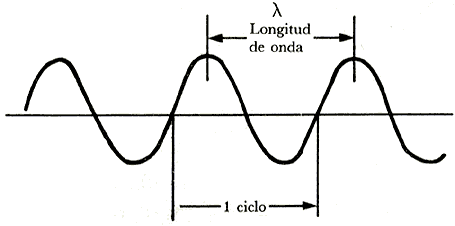
El número de ondas que a una velocidad constante pasan por un determinado punto
cada segundo se le llama frecuencia (v). Mientras menor sea la
longitud de onda, más ondas pasarán cada segundo, siendo por lo tanto mayor
la frecuencia, y cuando l es mayor, menos ondas pasarán
y por tanto la frecuencia será menor, por lo que, a la velocidad de la luz (c),
la frecuencia será inversamente proporcional a l.
![]()
Las radiaciones de mayor frecuencia tendrán también mayor energía, ya que la energía (E) es igual a la frecuencia y multiplicada por la constante de Plank (h), siendo h = 6.626x10-34 J.s. La energía será, por lo tanto, E = hv.
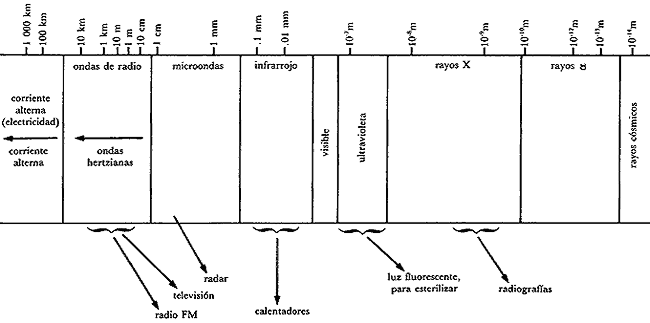
La pequeña porción del espectro electromagnético que percibe el ojo humano es llamada "luz visible" y está compuesta por radiaciones de poca energía, con longitudes de onda (l) que van de 400 a 800 nm (nm = nanómetro = 10-7 cm). La luz de menor longitud de onda (l = 400 nm) es de color violeta; le sigue la de color azul; después tenemos la luz verde, seguida de la luz amarilla y la anaranjada y, por último, a 800 nm, la luz roja con la que termina el espectro visible.
Antes del violeta, es decir a longitudes de onda menores de 400 nm, existen radiaciones de alta energía que el ojo humano no puede percibir, llamadas ultravioleta. Otras radiaciones de alta energía, y por lo tanto peligrosas para la vida, son los llamados rayos X y las radiaciones gamma. Por su parte, a longitudes de onda mayores que la de la luz roja (800 nm) existen radiaciones de baja energía, llamadas infrarrojo, microondas y ondas de radio.
El cuadro 2 muestra el espectro electromagnético, así como algunas de sus aplicaciones.
 |
El vapor de agua existente en la atmósfera primitiva de la Tierra estuvo expuesto a la radiación ultravioleta que durante millones de años llegó hasta la superficie terrestre sin dificultad. Las moléculas de agua eran descompuestas en hidrógeno (H2) y oxígeno (O2) por la alta energía del ultravioleta, el cual tiene una corta longitud de onda.
2H2O![]() 2H2+O2
2H2+O2
A pesar de que la producción de oxígeno era constante, la naturaleza reductora de la atmósfera se conservaba, ya que gran parte del oxígeno generado era consumido en la formación de óxidos con los elementos de la corteza terrestre y produciendo agua y nitrógeno al reaccionar con el amoniaco que abundaba en la atmósfera terrestre.
Por medio de este procedimiento la atmósfera se iba enriqueciendo en nitrógeno y oxígeno.
Parte del oxígeno que ingresaba en la atmósfera era activado por la radiación ultravioleta y transformado en su alótropo, una forma de oxígeno de alta energía llamado ozono (03). De esta manera se fue formando una capa protectora contra la radiación ultravioleta que se situó a una altura de alrededor de 30 km sobre la superficie terrestre. Esta capa de ozono protege a la Tierra de las radiaciones ultravioleta que, debido a su alta energía, son dañinas para la vida, ya que excitan a átomos y moléculas a tal grado, que puede hacer que un electrón abandone al átomo. La luz ultravioleta, al activar los átomos moleculares, puede dar origen a radicales libres. Si estos radicales forman parte de un ser vivo, pueden causarle trastornos graves como cáncer y aun conducirlo a la muerte.
Otras radiaciones con mayor energía que la luz visible, como los rayos X, son también peligrosas para la vida. En cambio, cuando la luz visible incide sobre un átomo excitará sus electrones haciendo que avancen a un estado mayor de energía, del cual regresarán inmediatamente liberando la energía que habían absorbido en forma de luz con la misma frecuencia que tenía la que los excitó.
Cuando una molécula ha sido excitada, el fotón absorbido la hará pasar a un
estado de mayor energía o estado excitado E*. Cuando esta
molécula excitada se relaja a un subestado vibracional o rotacional de inferior
energía, antes de que llegue a su estado basal emitirá luz a menor energía que
la absorbida. Este proceso se llama fluorescencia.
REACCIONES FOTOQUÍMICAS
Un tercer camino para relajarla es cuando la molécula excitada da como resultado
una reacción química o fotoquímica como, por ejemplo, en la reacción fotoquímica
que se lleva a cabo en el proceso de la visión.
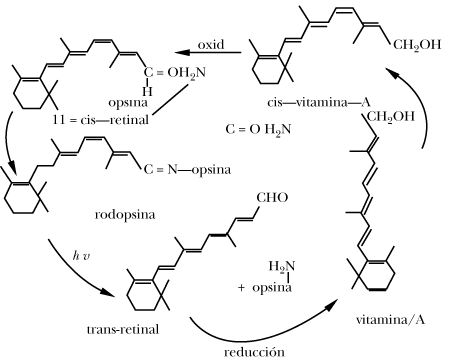
Cuando la luz llega a la retina, el retinal que forma parte de la rodopsina
sufre una reacción fotoquímica por medio de la cual cambia su geometría a trans
geometría que al no ser apropiada para unirse a la opsina provocará su separación
y el color cambiará del rojo púrpura al amarillo.
El trans retinal enseguida se reduce enzimáticamente a vitamina A decolorándose totalmente. Después la vitamina A es transportada al hígado en donde se transforma en 11-cis-vitamina A. Ésta es ahora transportada al ojo en donde al ser oxidada se transforma en 11cis-retinal que se combina con la opsina para dar rodopsina e iniciar de nuevo el ciclo visual.
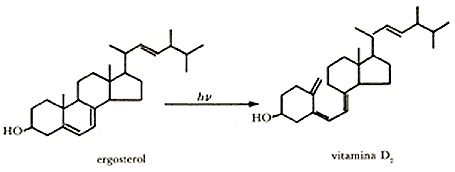
Otro ejemplo importante de reacción química provocada por la luz es la formación de vitamina D2 o antirraquítica.
El proceso que se puede realizar en el laboratorio es el mismo que sucede espontáneamente cuando las personas se exponen a los rayos solares.
Los niños que sufren de raquitismo (crecimiento deficiente de los huesos) se curan por exposición prolongada a la luz solar. Los alimentos al ser asoleados adquieren propiedades antirraquíticas.
La sustancia más activa para combatir el raquitismo es la vitamina D2 que se obtuvo al irradiar al ergosterol, una sustancia inactiva aislada de levadura.
La transformación fotoquímica del ergosterol en vitamina D2 es la que se muestra enseguida.
Reacciones fotoquímicas, como lo que se acaba de ilustrar, se pueden aplicar
a la transformación de diversas sustancias, lo que resulta de gran utilidad
en síntesis orgánicas.
La energía luminosa es también la base de las celdas fotovoltaicas que producen electricidad por excitación en el estado sólido.
CELDAS FOTOVOLTAICAS
Las celdas fotovoltaicas se han usado en el espacio desde 1958 para suministrar
energía eléctrica a los satélites artificiales. Y esto debido a que son muy
eficientes en la conversión de energía solar a energía eléctrica (ñ 20%), aunque,
debe aclararse, tienen el inconveniente de ser muy caras.
La solución, desde luego, radica en abaratar el procedimiento para poder utilizarlo en la Tierra en forma competitiva.
El procedimiento está basado en la propiedad que tiene la energía luminosa de excitar los electrones de los átomos. Si sobre un cristal de silicio, cuyos átomos tienen cuatro electrones de valencia, se hace incidir la luz, éstos serán excitados y podrán abandonar el átomo, dejando un hueco que equivale a una carga positiva, el cual atraerá a un electrón de un átomo vecino, generando en él un nuevo hueco. De esta manera las cargas negativas (electrón) y las positivas (hueco) viajarán libremente por el cristal y al final quedarán balanceadas.
Si la mitad del cristal contiene como impureza un elemento que, como el arsénico, contiene cinco electrones de valencia, a cada átomo le sobrará un electrón que se moverá por el cristal, aunque los electrones extra se encuentren neutralizados por los protones del núcleo del arsénico.
Si la impureza en la otra mitad del cristal en vez de ser arsénico es un elemento como el boro, es decir con sólo tres electrones de valencia, dará la posibilidad de crear huecos con facilidad.
Si-Si-Si-Si-Si-Si Si-Si-As-Si-Si-Si Si-As-Si-Si-Si-Si Si-Si-Si-Si-Si-Si Si-Si-Si-Si-Si-Si Si-Si-B-Si-Si-Si Si-B-Si-Si-Si-Si Si-Si-Si-Si-Si-Si |
Así, los electrones se difundirán en ambas partes del cristal hasta llegar a
un equilibrio.
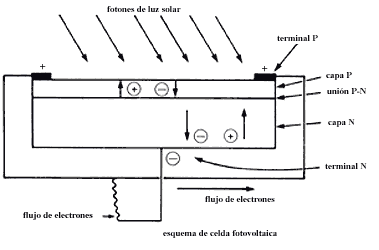
Con los elementos anteriores se puede hacer una celda fotovoltaica (Figura 10).
La parte con exceso de electrones, a la que se llamará N (negativa), se une a la que contiene cargas positivas móviles P (huecos).
Cuando la luz solar incide sobre el cristal, los electrones de la parte N se liberan y dirigen hacia un electrodo conectado con la parte positiva P, rica en huecos. Como existe una barrera entre la parte positiva y la negativa, se evita la recombinación de electrones y huecos haciendo que los electrones pasen a través del alambre y generen una corriente eléctrica. Por tanto, la corriente fluirá constantemente mientras la luz incida sobre la celda.
FOTOSÍNTESIS
En la fotosíntesis ocurre un proceso similar al descrito para las celdas fotovoltaicas.
Aunque en aquélla no se produce una corriente eléctrica, es sin embargo más
eficiente que el realizado en una celda fotovoltaica artificial.
La clave para tan alta eficiencia reside en la arquitectura molecular y en su asociación a membranas. Las membranas biológicas consisten en un fluido bicapa de lípidos anfipáticos especialmente fosfolípidos. La naturaleza anfipática de estos lípidos se debe a que presentan hacia el exterior la parte polar (cargada) de los fosfolípidos, la que es atraída hacia el medio acuoso. La parte interior de la membrana está constituida por las colas (no polares) de los fosfolípidos que forman una barrera entre los medios acuosos.
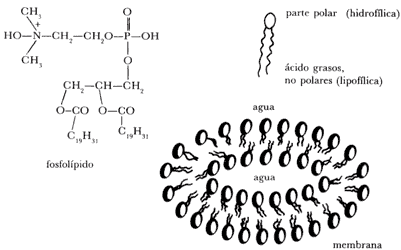
Figura 11.
Esta bicapa fosfolípida constituye una membrana y actúa como barrera semipermeable
separando dos compartimientos acuosos (Figura 11). Por ejemplo, un glóbulo rojo
está formado por una membrana que separa al citoplasma acuoso intracelular del
plasma sanguíneo, que también es acuoso.
En los organismos fotosintéticos existen proteínas, colorantes y moléculas sensibilizadoras embebidas en la membrana de las células especializadas en la fotosíntesis.
En algas y plantas verdes, el aparato fotosintético se encuentra localizado en organelos intracelulares unidos a proteínas que se llaman cloroplastos.
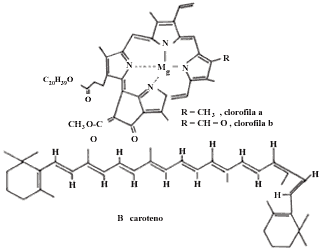
La molécula sensibilizadora en la fotosíntesis es la clorofila, molécula parecida a la del heme de la hemoglobina, que consiste en un anillo tetrapirrólico que contiene un átomo de Mg en el centro del anillo en vez del átomo de Fe que contiene el heme.
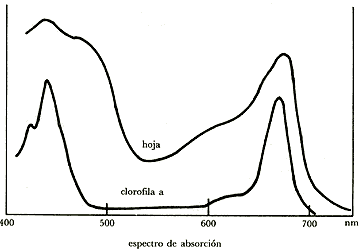
La clorofila absorbe luz para iniciar la reacción de fotosíntesis. La intensidad de absorción en las distintas l del espectro visible varían de acuerdo con la figura 12. Como en ella se ve, la clorofila absorbe en el azul y en el rojo y no en el verde, el cual es reflejado, razón por la que las hojas se ven verdes.
El aparato fotosintético consta de clorofila y una serie de pigmentos como carotenos y xantofilas, todos ellos unidos a una proteína embebida en una membrana, lo que permite una buena transmisión de energía.
Los pigmentos diferentes a la clorofila ayudan a absorber en las ls
entre 450 y 650 nm, punto en que la clorofila es deficiente. Las cantidades
y proporciones de pigmentos secundarios varía de planta a planta, siendo precisamente
éstos los que le dan el color característico a las hojas. De aquí que se puedan
encontrar de tono azulado, como en algunos eucaliptos; de tono amarillo, como
en la lechuga, o de tono rojizo, como en algunos amarantos.
Los pigmentos que absorben la luz, situados en la membrana, se hallan dispuestos en conjuntos. Estos fotosistemas contienen alrededor de 200 moléculas de clorofila y algunas 50 de carotenoides. Todas las moléculas del conjunto pueden absorber luz, pero sólo una molécula de clorofila, combinada con una proteína específica, transforma la energía luminosa en energía química, por lo que recibe el nombre de centro de reacción fotoquímica. Todas las demás moléculas son colectoras o moléculas antena.
Las membranas de los cloroplastos poseen dos diferentes fotosistemas cada una, con su propio conjunto de moléculas colectoras y su centro de reacción. El fotosistema l, que absorbe a l mayores (800 nm), tiene una mayor proporción de clorofila a y el fotosistema II, que absorbe a l menores (680 nm), tiene mayor proporción de clorofila b.
Todas las plantas que desprenden oxígeno poseen ambos fotosistemas, siendo el agua oxidada en el lado derecho, como se muestra en la figura 13, y el NADP+ reducido en el lado izquierdo. Es también interesante notar que existen trampas de luz (fototrampas), oxidación de agua y reducción de NADP+. En la oxidación de H2O la molécula de clorofila sensibilizadora tiene un pico de absorción de luz a 680 nm y se designa como P680. El complejo total del lado de oxidación de H2O de la Z es llamado fotosistema II. Después de la absorción de energía luminosa se forma P680* (excitado), que por oxidación pasa a P680+ (oxidado), mientras se reduce un aceptor que es plastoquinona, acomplejada con heme sin fierro. El producto reducido es el radical libre de una hemequinona que ha sido identificado por resonancia spin electrón. La localización en la membrana del P680 y su plastoquinona proviene de la recombinación de cargas, pero el P680+ es también rápidamente reducido por los electrones tomados del agua. De hecho, después de cuatro eventos fotoquímicos se observa emisión de O2.
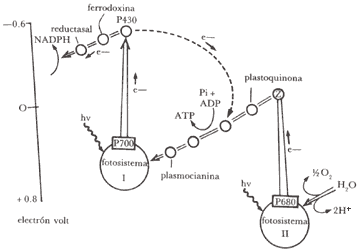
donde por cada electrón que proporciona el agua y recorre el camino hasta NADP+, se absorben dos cuantos de luz.
Para formar una molécula de O2 deben absorberse un total de ocho cuantos para cada fotosistema.
FORMACIÓN DE AZÚCARES Y OTROS COMPUESTOS ORGÁNICOS
Los organismos fotosintéticos producen glucosa y otros azúcares a partir del
CO2 atmosférico y el agua del suelo, usando la energía solar
acumulada en el ATP y el NADPH
El proceso descubierto por Melvin Calvin es el siguiente:
6 CO2 + 18 ATP + 12 H2O
+ 12 NADPH + 12 H+ ![]() C6H12O6
+ 18 Pi + 18 ADP + 12 NADP+
C6H12O6
+ 18 Pi + 18 ADP + 12 NADP+
El azúcar de cinco átomos de carbono se combina con CO2, catalizado por la enzima carbonílica 1,5-difosfato de ribulosa, produciendo dos moléculas de ácido fosfoglicérico, el que se combina entre sí para dar el azúcar de fruta o glucosa.
REFERENCIAS
1. A. 1. Oparin, The Origin of Life on the Earth, 3a edición, Academic
Press Inc., editores, Nueva York, 1957.
2. M. Harvath, L. Bilitzki y J. Hñttner, Ozone, Elsevier, Amsterdam Oxford, Nueva York, 1957.
3. K. Zweibel, "Photovoltaic cells", en Chem. and Eng. News,7 de julio, p. 34 (1986).
4. Ch. L. Bering, "Energy interconvertions in photosynthesis", en J. Chem. Ed. 62, 659 (1985).
5. Zelitch 1., "Photosynthesis and plant productivity", en Chem. and Eng. News, 5 de febrero, p. 28 (1979).
6. A. L. Lehninger, Principies of biochemistry, Worth publishers, Inc., Nueva York, 1982.
7. Magdalena Rius de Riepen y C. Mauricio Castro Acuña, La química hacia la conquista del Sol, SEP-FCE-CONACYT (La ciencia desde México, 10), México, 1986.