V. MOTORES Y MÁQUINAS SIMPLES: MECANOENZIMAS Y POLÍMEROS DE SOPORTE
PARA proceder en el orden cronológico de sus respectivos descubrimientos, entre los motores celulares debe mencionarse, en primer lugar, a la miosina, la cual se describió e ilustró en capítulos anteriores.
La miosina, con sus dos cabezas en uno de sus extremos, tiende espontáneamente
a formar fascículos con un arreglo peculiar. Cada molécula se une a otra con
orientación opuesta, empalmando las colas, y cada una de estas parejas se asocia
lateralmente con otras parejas hasta constituir fibras en donde las cabezas
quedan asomando escalonadamente en la periferia del fascículo. Constituida de
esta manera, la apariencia de la fibra es similar a la que presentaría un ramo
doble de rosas en botón, en el que las varas sin hojas estarían empalmadas en
sentido contrario, y los botones quedarían expuestos alternada y simétricamente
a lo largo de los extremos. Las cabezas de miosina son enzimas capaces de hidrolizar
ATP y aprovechar la energía liberada (Figura V. 1). La miosina
utiliza esta energía para modificar de manera transitoria su propia conformación,
y puesto que este cambio produce trabajo mecánico, como veremos a continuación,
se trata de una mecanoenzima.
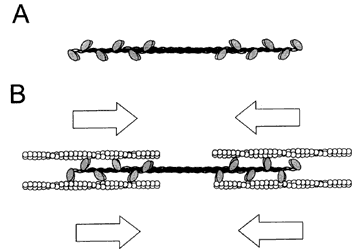
Figura V. 1. Filamento de miosina II y su interacción con microfilamentos
de actina. A) Múltiples moléculas de miosina asociadas para formar un filamento
bipolar. B) La interacción de filamentos de miosina con filamentos de actina
produce el deslizamiento de estos últimos.
Cuando una de estas fibras se encuentra con un microfilamento alineado en paralelo,
las cabezas de miosina propenden a acoplarse con las moléculas de actina, favoreciendo
una firme asociación entre ambas estructuras. Es entonces cuando, en presencia
de ATP, se expresan las propiedades motoras de la miosina y sus
cabezas literalmente caminan a lo largo del filamento. Al igual que el movimiento
de un pie, este notable fenómeno ocurre en varias etapas: 1) separación
del punto de contacto inicial; 2) avance hacia una nueva posición; 3)
afianzamiento en el nuevo punto de contacto, y 4) efecto de arrastre
sobre el resto de la estructura en esa dirección. Las moléculas de ATP
participan en las dos primeras etapas a través dos acciones. Por una parte,
tienen la virtud de desprender las cabezas de miosina del filamento de actina;
por la otra, ceden su energía para permitir que las cabezas ya liberadas se
enderecen de su condición retraída normal y puedan alcanzar el siguiente punto
de anclaje. Así, cada molécula de ATP, de éste toma energía para
enderezarse, y se ancla nuevamente en un punto vecino al filamento. Al concluir
este último paso, la cabeza de miosina se vuelve a retraer y, puesto que se
halla unida al filamento de actina, la retracción se refleja en el arrastre
de su cola (Figura V.2). El ciclo se repite una y otra vez, siempre que haya
ATP disponible. Una cabeza de miosina consume la energía que aportan
entre 5 y 10 moléculas de ATP cada segundo para desarrollar este
trabajo. Dado que otras cabezas de miosina en esa misma fibra efectúan un proceso
equivalente, la fibra se desplaza longitudinalmente sobre el filamento.
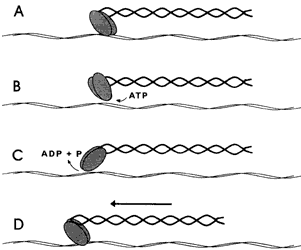
Figura V. 2. Interacción de una molécula de miosina II con un filamento
de actina. A) En estado de reposo la cabeza de miosina se encuentra firmemente
asociada al filamento. B) La unión con una molécula de ATP le permite
desprenderse del filamento. C) Una vez suelta, la cabeza de miosina hidroliza
el ATP y aprovecha la energía liberada para cambiar de conformación
y alcanzar un sitio algo más distante sobre el filamento. D) Al ser eliminado
el ATP la cabeza de miosina vuelve a asociarse al filamento en
el nuevo sitio alcanzado. A la vez recupera automáticamente su conformación
original y tira del resto de la molécula en la dirección del avance. Nuevas
moléculas ATP permiten la repetición sucesiva del ciclo y el avance
lento sobre el filamento.
Esta descripción del funcionamiento de un motor molecular no es producto de la imaginación. Aunque no es posible ver directamente la interacción dinámica entre las moléculas de actina y miosina, existen numerosos indicios de que así es como opera, hace algunos años se obtuvo una prueba contundente de ello. Los investigadores purificaron moléculas de miosina a partir de músculo de conejo, y las fijaron por métodos químicos sobre esférulas de un material sintético visible al microscopio. Cuando estas esférulas se pusieron en contacto con los filamentos de actina que existen en ciertas algas verdes, de inmediato se observó que migraban a lo largo de los filamentos, y el movimiento sólo ocurrió si existía ATP en el medio. Además de corroborar la teoría formulada previamente acerca del mecanismo de deslizamiento de fibras de miosina sobre filamentos de actina, este ingenioso experimento puso en evidencia que dicho mecanismo es común en células tan distintas y distantes entre sí, desde el punto de vista evolutivo, como son las del músculo de un animal superior y las de una planta primitiva. Se trata, por consiguiente, de un recurso tan eficaz que la evolución lo ha conservado y distribuido entre una gran variedad de organismos para desempeñar múltiples funciones.
Un filamento de actina se convierte así en una pista para que la miosina camine
sobre él, y esto impone una orientación definida al movimiento en el espacio
tridimensional. Además, tal como sucede con la mayoría de las pistas, aparte
de que el desplazamiento debe efectuarse a lo largo del filamento, la dirección
está también determinada: las cabezas de miosina pueden caminar únicamente en
un sentido. Esto es consecuencia de la polaridad estructural de los filamentos
de actina, que acepta la asociación entre ambas clases de moléculas exclusivamente
en una posición específica, de manera análoga o como los asientos de un avión
determinan una posición regular y orientada de los pasajeros. Esta propiedad
puede demostrarse luego de exponer filamentos desnudos ante una multitud de
cabezas de miosina dispersas en una solución carente de ATP. En
tales condiciones, por lo explicado antes, la miosina se adhiere con firmeza
a los filamentos, y el microscopio electrónico revela que la adhesión ocurre
de acuerdo con un arreglo preciso. Las cabezas aparecen recubriendo por completo
cada filamento, ordenadas una junto a otra como pequeñas salientes inclinadas
que dan al conjunto el aspecto de una apretada serie de puntas de flecha, similar
al de una espiga de trigo (Figura V.3). Se dice entonces que el filamento fue
decorado con las cabezas de miosina, y ello constituye una prueba contundente
de que se trata de un filamento de actina. Cuando las cabezas forman parte de
una fibra de miosina en la condición natural, el desplazamiento de la fibra
es en dirección contraria a aquella en la que señalan las puntas de una flecha.
En términos de la polaridad del filamento de la actina, esta dirección es la
que ve hacia el extremo (+), o aquél en donde ocurre preferentemente la adición
de moléculas de actina durante la polimerización.
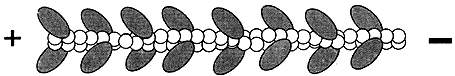
Figura V. 3. Filamento de actina decorado con miosina II.
La explicación de los mecanismos que median la interacción motora de la miosina con los filamentos de actina ha sido un camino arduo en el que han participado muchos brillantes investigadores, y dista aún de completarse en todos sus detalles. Sin embargo, por compleja que pueda parecer la descripción dada en los párrafos anteriores, el principio de operación es, en última instancia, el de una de las máquinas más simples inventadas por el hombre; corresponde a lo que en mecánica se llama un trinquete, es decir, un dispositivo en el que una uñeta avanza a lo largo de un poste, clavándose sucesivamente en ranuras hendidas de manera periódica sobre la superficie del mismo. En cada paso, la uñeta se separa de la ranura que ocupa y alcanza la ranura siguiente, donde se engancha para iniciar un nuevo ciclo. La forma de la uñeta y las ranuras es complementaria y oblicua con respecto al eje del poste, de tal modo que el avance sólo puede efectuarse en una dirección; el mecanismo se atranca en la dirección contraria. De manera análoga, la miosina avanza unidireccionalmente como una uñeta sobre el filamento de la actina. La única diferencia fundamental es que la uñeta del trinquete mecánico responde pasivamente a una fuerza externa —aplicada por la mano de un operador; por ejemplo— , mientras que la miosina consume energía directamente para realizar ella misma todo el trabajo. La energía obtenida del ATP es utilizada por la miosina de manera específica para enderezar la cabeza y ponerla en posición de alcanzar un nuevo sitio de anclaje. Es por esta razón que la miosina, a diferencia del trinquete, es un motor.
Dado que las cabezas de miosina deben tener una orientación particular para asociarse funcionalmente con los filamentos de actina, una fibra de miosina, organizada simétricamente con cabezas caminantes apuntando en direcciones opuestas, sólo puede interaccionar con filamentos orientados de manera adecuada en cada uno de sus dos extremos. Sin embargo, el extremo opuesto puede interaccionar con filamentos de actina colocados en posición antiparalela, es decir, cuya polaridad esté invertida con respecto a los primeros. La actividad motora de la miosina en ambos extremos de la fibra resultará entonces en una aproximación de los dos conjuntos de filamentos de actina, si éstos se encuentran libres. Pero si, como es habitual, los filamentos se encuentran unidos en sus cabos distantes con membranas u otros componentes celulares, tales componentes experimentarán una fuerza de tracción hacia la zona en que se halla la miosina. Puesto que las fibras de miosina tienen cabezas caminantes proyectadas en diversos ángulos en torno a su eje, cada fibra puede interaccionar a la vez con varios filamentos de actina en cada extremo. Se multiplica así el trabajo realizado por la fibra y aumenta la fuerza que es capaz de generar. Este es, esencialmente, el fenómeno que ocurre durante la contracción muscular aunque, como veremos en capítulos posteriores, las células aprovechan este mecanismo para diversos fines. La combinación de este motor molecular—la miosina— con filamentos que transmiten la fuerza constituye una (de las máquinas biológicas más ubicuas y, por consiguiente, más estudiadas y mejor comprendidas. Veamos ahora otros ejemplos.
El funcionamiento del complejo actina-miosina hace patente que las estructuras
del citoesqueleto resultan ideales como puntos de apoyo, guías y líneas de transmisión
de las fuerzas desarrolladas por los motores moleculares en las células. No
sorprende, por tanto, que los microtúbulos, algo más rígidos y resistentes que
los filamentos de actina, constituyan el soporte para la operación de otros
motores moleculares. Y en retrospectiva, tampoco causa mucho asombro que tales
motores estén diseñados conforme al mismo principio que la miosina. De hecho,
al menos en el primer caso que abordaremos a continuación, existe una gran similitud
(Tabla 1) .
|
|
|||||
|
Miosina I
|
Miosina II
|
Dinamina
|
Cinesina
|
Dinaína
|
|
|
|
|||||
| Peso molecular | 110-140 Kda.. | 200 Kda. | 100 Kda. | 120 Kda. | 400-500 Kda. |
| Número de cabezas | 1 | 2 | 1 | 2 | 2 ó 3 |
| Proteínas y organelos con los que se une | actina y/o vesículas | miosina II | microtúbulos | vesículas | microtúbulos o vesículas |
| ATPasa activada por | microfilamentos de actina | microfilamentos de actina | microtúbulos | microtúbulos | microtúbulos |
|
|
|||||
La dinaína —la proteína de la fuerza— es otra mecanoenzima que utiliza
energía derivada de la hidrólisis del ATP para cambiar transitoriamente
su conformación. Se trata también de una molécula de grandes dimensiones integrada
por varias subunidades, las mayores de las cuales son dos cabezas globulares
con un peso de 410 000 daltones cada una, en las que reside la actividad de
ATPasa. Esta actividad aumenta sustancialmente en presencia de
microtúbulos. La dinaína fue inicialmente identificada como el motor que genera
el movimiento de apéndices vibrátiles llamados cilios y flagelos que ciertas
células poseen. En fechas más recientes ha podido comprobarse que hay otras
formas de dinaína distribuidas en el citoplasma de una vasta variedad de organismos.
La característica distintiva de las dinaínas es su capacidad para avanzar sobre
los microtúbulos, de manera análoga a como lo hace la miosina sobre los filamentos
de actina (Figura V.4). Cabe aclarar que esta interacción es por el exterior
y no por la estrecha luz de los microtúbulos, como justificadamente alguien
pudiera pensar. Todo indica que las cabezas de la dinaína se afianzan a un sitio
en la pared de los microtúbulos, en seguida cambian bruscamente de forma, y
luego se desprenden para enderezarse y afianzarse en un nuevo sitio, repitiendo
el ciclo sin cesar mientras dispongan de ATP.
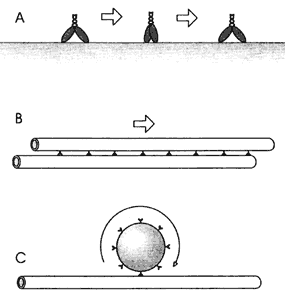
Figura V. 4. Interacción de la cinesina con microtúbulos. A) Mecanismo básico
propuesto para la acción de la cinesina; B) desplazamiento de microtúbulos,
uno con respecto a otro, a través de la cinesina; C) movimiento mediado por
cinesina de una partícula sobre un microtúbulo.
Puesto que normalmente las moléculas de dinaína están unidas a estructuras
celulares por el extremo opuesto al de las cabezas motrices, dichas estructuras
responden al esfuerzo de arrastre que se ejerce sobre ellas. Cuando la dinaína
se halla asociada con una vesícula o algún otro tipo de partícula en libertad
para desplazarse, ésta migra a lo largo del microtúbulo. Pero si la dinaína
se encuentra anclada en otro microtúbulo, se produce un deslizamiento de un
microtúbulo sobre el otro y cada uno de ellos actúa como elemento de transmisión
de la fuerza generada hacia las partes de la célula con las que esté conectado
mecánicamente. El fenómeno puede reproducirse experimentalmente colocando microtubulos
purificados sobre una laminilla de vidrio recubierta con moléculas de dinaína;
se observa entonces que los microtúbulos se deslizan paralelamente a la superficie
si el medio está provisto de ATP.
Al igual que en la máquina constituida por actina y miosina, la polaridad de
los microtúbulos determina la dirección del avance de la dinaína sobre ellos.
Una diferencia importante, sin embargo, es que en este caso el sentido del movimiento
apunta hacia el extremo (-) del microtúbulo, es decir; el menos propicio para
la adición de moléculas de tubulina durante su polimerización. Por fortuna,
en los últimos diez años han aparecido otros dos tipos de mecanoenzimas —las
cinesinas o proteínas del movimiento (120 000 daltones) y la dinamina o proteína
de la potencia (100 000 daltones)— con propiedades y funciones semejantes
a las de las dinaínas, pero que se trasladan en sentido contrario al de éstas
sobre los microtúbulos (figura .V.5). En consecuencia, un mismo microtúbulo
puede servir como soporte y guía para movimientos de otros componentes celulares
en ambas direcciones.
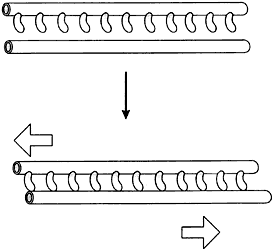
Figura V. 5. Desplazamiento de microtúbulos mediado por la dinaína.
Hemos completado así un inventario mínimo de partes e ingredientes indispensables para la integración y el funcionamiento de la maquinaria que mueve a las células, y a través de estas últimas a la mayoría de los seres vivientes. La lista incluye los tres principales componentes del citoesqueleto —encargados de mantener la forma de las células y la distribución de estructuras en su interior —, una familia de cuatro tipos de motores moleculares capaces de generar fuerzas sobre algunos polímeros del citoesqueleto, y el combustible necesario para alimentar estos motores. Vimos también que las máquinas simples constituidas por la combinación de motores y polímeros del citoesqueleto pueden desarrollar tensión entre puntos específicos de una célula o acarrear estructuras a través de su citoplasma. Pasaremos ahora a examinar cómo estas máquinas simples se reúnen en conjuntos armónicos para integrar aparatos que desempeñan muy variadas funciones.
SISTEMAS DE TRANSPORTE COLECTIVO
Ya hemos dicho que cuando las moléculas de miosina, dinaína, cinesina y dinamina disponen de energía suministrada por el ATP tienen la capacidad de caminar en sentido unidireccional sobre los microfilamentos de actina o a lo largo de los microtúbulos, respectivamente, y que en cada caso el sentido del avance está determinado por la polaridad del polímero lineal correspondiente. En consecuencia, un arreglo en paralelo de múltiples polímeros del mismo tipo constituye una verdadera pista para el tráfico de los motores moleculares respectivos. Esta clase de arreglo es aprovechada por muchas células para realizar un acarreo dirigido de materiales por su interior.
Un ejemplo típico de este fenómeno se encuentra en numerosas células vegetales.
En presencia de luz —es decir, cuando hay producción de ATP
gracias a la fotosíntesis— el contenido celular es circulado ininterrumpidamente
a velocidades de hasta 100 micras por segundo, dentro de pasadizos internos
que a menudo atraviesan o circunvalan un enorme espacio libre o vacuola central
(Figura V.6). Mediante este proceso la célula asegura una distribución homogénea
de nutrientes y otras sustancias en su interior. El espectáculo de estas corrientes
intracelulares ha cautivado a los microscopistas por más de 200 años, desde
que en 1774 Corti lo describió por primera vez; pero no fue sino hasta la década
pasada que logró aclararse el principio general que explica el fenómeno.
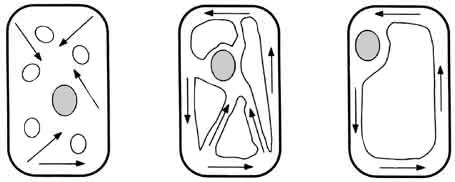
Figura V. 6. Varios tipos de corrientes citoplásmicas en células vegetales.
Por lo regular; el movimiento se origina en la cercanía de largas fibras que
pueden estar dispuestas de diversas maneras en el interior de las células. El
deslizamiento del citoplasma siempre es paralelo a estas fibras y con una velocidad
máxima en la vecindad inmediata a las mismas. Las fibras que dirigen el movimiento
tienen un diámetro aproximado de 0.2 micras, pero cuando son examinadas con
un microscopio electrónico aparecen corno cables integrados por múltiples filamentos
con un calibre individual de entre cinco y siete nanómetros. Estos filamentos
pueden ser decorados artificialmente con cabezas de miosina, como se explicó
en el capítulo anterior, por lo que no hay duda de que son polímeros de actina.
Es más, como también se mencionó antes, se ha demostrado que en presencia de
ATP y en condiciones propicias los cables compuestos por estos
filamentos pueden servir como base y guía para la migración de cabezas de miosina
obtenidas de músculo de conejo.
El tratamiento de las células vegetales con citocalasinas —que como se
recordará inducen la despolimerización de los filamentos de actina o con inhibidores
metabólicos que disminuyen la producción de ATP, interrumpe de
manera drástica el flujo intracelular. Puesto que también se sabe que las células
vegetales —al igual que las de origen animal— tienen una dotación de
moléculas de miosina, está claro que las corrientes cito plásmicas en las plantas
se generan porque estas moléculas se impulsan sobre filamentos de actina mediante
un proceso dependiente de ATP (Figura V.7).
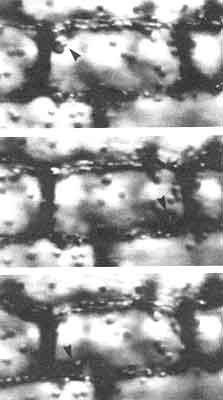
Figura V. 7. Corrientes citoplásmicas en una célula vegetal. Secuencias
videomicroscopicas del movimiento de los cloroplastos dentro de una célula de
la planta acuática Vallisneria. Los cloroplastos se mueven en círculos
alrededor de la célula utilizando la interacción de actina y miosina. Las flechas
señalan un mismo grupo de cloroplastos en 3 posiciones sucesivas.
De manera análoga a lo que sucede con las calles y avenidas de una ciudad, los cables de filamentos de actina pueden ser transitados por las moléculas de miosina en doble sentido o en una sola dirección. Puesto que cada filamento permite el avance únicamente en un sentido, el tránsito en uno o en dos sentidos depende de la orientación de los filamentos que componen el cable. Si todos los filamentos tienen su polaridad orientada en el mismo sentido, el movimiento será necesariamente unidireccional; pero si el cable está formado por filamentos dispuestos de modo antiparalelo, es decir, con sus polaridades orientadas en sentidos opuestos, constituye una pista sobre la que las moléculas de miosina podrán migrar en ambas direcciones.
Las moléculas de miosina recorren los cables de filamentos de actina como unidades
libres, o bien como vehículos de carga si están asociadas con vesículas y otras
pequeñas estructuras. El desplazamiento activo de estos componentes ocasiona
un efecto de arrastre pasivo sobre el fluido circundante, por lo que si el movimiento
es unidireccional se produce un flujo continuo en la capa de citoplasma contigua
al cable. Cuando existe un conjunto de cables paralelos, los flujos respectivos
se suman y afectan regiones de citoplasma más distantes, generándose así una
verdadera corriente que pone en circulación prácticamente la totalidad del contenido
celular (Figura V.8).
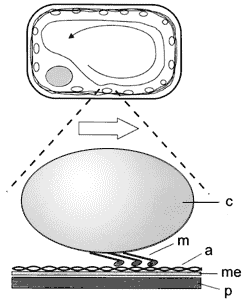
Figura V. 8. Mecanismo propuesto de corriente citoplasmica: a =actina, c
= cloroplasto, m = miosina, me = membrana, p = pared celular.
Al igual que los filamentos de actina, los microtúbulos también pueden constituir
pistas para la migración de motores moleculares. El caso más notable de esto
es el llamado transporte axoplásmico que tiene lugar en el interior de las prolongaciones
cilíndricas o axones de las células nerviosas o neuronas. Estas prolongaciones,
tradicionalmente conocidas como fibras nerviosas, son las que permiten la transmisión
de señales entre puntos específicos del sistema nervioso, y pueden alcanzar
longitudes de decenas de centímetros e incluso metros en animales de gran tamaño.
Si bien las señales conducidas son en su mayoría de naturaleza eléctrica y se
propagan por la membrana que limita cada axón, existe además un atareado acarreo
de materiales por dentro de la fibra, es decir, a través del axoplasma. Proteínas,
gránulos, mitocondrias, y vesículas de diversos tamaños emplean este sistema
de transporte colectivo para viajar de un extremo a otro de las células nerviosas.
El proceso ocurre de manera continua en ambos sentidos de la fibra, simultáneamente,
con velocidades de hasta cinco micras o algo más por segundo (casi medio metro
en 24 horas) que, convertidas proporcionalmente a una escala más familiar; serían
comparables a la de un automóvil compacto corriendo a unos 120 km por hora.
El transporte por el interior del axón permite a la neurona suministrar a sus
prolongaciones y a sus remotas terminales los componentes que requieren para
su mantenimiento y funcionalidad, así como recibir mensajes de tipo químico
acerca de las células con que está directamente conectada (Figura V.9).
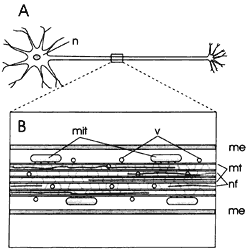
Figura V. 9. Transporte axoplásmico. A) Representación del axón en una neurona;
B) amplificación mostrando vesículas transportadas a lo largo del axón por el
citoesqueleto: mt = microtúbulos interconectados con la matriz citoplasmica,
mit = motocondrias, nf = neurofilamentos, me = membrana celular, v = vesículas.
Las prolongaciones, en ocasiones muy ramificadas, que otorgan a las neuronas su apariencia singular, no serían posibles sin un armazón interno que les ayude a mantener una forma tan asimétrica. Dicho armazón está constituido desde luego por el citoesqueleto; de hecho, las células nerviosas son quizás el ejemplo más destacado de hasta qué punto el citoesqueleto puede obligar a que las células embrionarias, originalmente globulares, adopten morfologías adecuadas a funciones particulares. El microscopio electrónico revela que la estructura más prominente de toda fibra nerviosa es una columna de microtúbulos asociados lateralmente entre sí por medio de numerosos brazos transversales. En muchos casos se encuentran también filamentos longitudinales de 10 nanómetros de grueso, llamados neurofilamentos, que por sus características pertenecen a la familia de los filamentos intermedios. Además de proporcionar estabilidad estructural a la fibra, los microtúbulos desempeñan un papel central en el mecanismo del transporte axoplásmico. La colchicina, la vinblastina y otras drogas que despolimerizan los microtúbulos, imposibilitan la continuidad del transporte. Por otra parte, cualquier condición que dificulte la producción de ATP —falta de oxígeno, sustancias tóxicas para las mitocondrias, etc.— detiene el proceso en poco tiempo. Como hemos visto, estas propiedades —interrupción del movimiento por trastorno del citoesqueleto o por carencia de energía metabólica— son características de los fenómenos mediados por motores moleculares. Sin embargo, sólo hasta en fechas muy recientes consiguió establecerse la identidad de tales motores.
En 1985, mediante laboriosos procedimientos bioquímicos, se logró aislar del axoplasma un complejo de proteínas que tiene la habilidad de efectuar muy curiosos malabares. Al ser agregado, junto con ATP, a una suspensión de microtúbulos sueltos, hace que éstos repten sobre el vidrio de la cámara de observación o que se deslicen unos contra otros. Si los microtúbulos se sujetan artificialmente al vidrio con un adhesivo y se añaden luego vesículas obtenidas también del axoplasma, además de ATP; la proteína hace que las vesículas marchen a lo largo de los microtúbulos. Se trata, pues, de un translocador que actúa en concierto con los microtúbulos; sí éstos están libres puede moverlos con respecto a una superficie de sostén, pero si están fijos su acción se refleja en el movimiento de pequeñas partículas sobre los mismos microtúbulos. Como conviene a un sistema de transporte colectivo, el translocador resultó no ser específico, ya que mueve toda clase de carga dadas las dimensiones apropiadas. En esta misma serie de experimentos se constato que la proteína es capaz de transportar perlitas microscópicas de látex. Ésta es en resumen la historia del descubrimiento de la cinesina, uno de los motores moleculares que opera en asociación con los microtúbulos.
La investigación posterior ha comprobado que la cinesina es el vehículo del transporte axoplásmico, y que la columna de microtúbulos en el axoplasma ofrece guía y soporte para el traslado de componentes a lo largo del axón. Sin embargo, a diferencia de los cables de filamentos de actina en las células vegetales, los microtúbulos que se encuentran en el axoplasma tienen su polaridad orientada casi exclusivamente en un solo sentido. La cinesina, que al igual que los demás motores moleculares sólo transita en una dirección sobre su polímero correspondiente, migra en los axones alejándose del cuerpo celular. Como ya explicamos, el transporte axoplásmico es bidireccional, y por ello el flujo en sentido opuesto requiere de alguna explicación. La respuesta para este enigma parece residir en la dinaína, un translocador que avanza sobre los microtúbulos en dirección inversa llevarse a cabo a la cinesina. El ir y venir simultáneo de diferentes materiales a lo largo del axón puede mediante un sistema compuesto únicamente por una sola columna de microtúbulos orientados de idéntica manera, y dos tipos de transiocadores que marchan en direcciones opuestas.
El transporte axoplásmico ha sido de gran utilidad para determinar con precisión la conectividad en el sistema nervioso, ya que, para indagar con qué otras células está conectada una neurona, basta inyectar en ella una sustancia reconocible, y examinar al cabo de algún tiempo el paradero de dicha sustancia en las regiones donde se sospecha que llegan sus prolongaciones. Desafortunadamente esta misma capacidad de transporte indiscriminado es aprovechada por ciertos virus para invadir las neuronas. La rabia, la polio y un tipo de herpes se propagan por las vías nerviosas a través de este mecanismo.
Además del movimiento interno en las células generado por las diferentes máquinas
que forman el citoesqueleto, muchas células necesitan desplazarse a diferentes
partes de su hábitat, y en los organismos multicelulares algunas se mueven de
un órgano a otro. Este sería el caso de los glóbulos blancos que se desplazan
al sitio de una infección, de las células embrionarias que se reorganizan para
formar órganos, y de las células invasoras o cancerosas. Los leucocitos, macrófagos,
y las células embrionarias y cancerosas se desplazan proyectando pseudópodos
o pies falsos, que mueven sobre diferentes tipos de soporte o en un medio líquido.
En este tipo de células los pseudópodos se forman y se retraen en forma
constante para permitir el desplazamiento (figura V.10). La célula se proyecta
hacia adelante cuando se forma un pseudópodo en esa dirección y una fuerza motora
jala al resto de la célula también hacia adelante. A este tipo de movimiento
se le llama amiboideo, por haberse observado inicialmente en organismos unicelulares
de la clase Amoebina o amibas, que por cierto han sido objeto de gran
interés para los usuarios de microscopios ópticos.
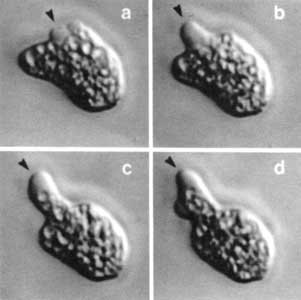
Figura V.10. Secuencia videomicroscópica de una amiba en movimiento. La
dirección del movimiento es señalada por la proyección del pseudópodo anterior
(flecha), en donde el citoplasma carece de organelos.
Para que una célula se mueva utilizando sus "pies" necesitará, como en el caso de un ser humano, de algo análogo a lo que son los huesos y los músculos que permiten el sostén y la propulsión del cuerpo. En el caso de una célula, el citoplasma se proyecta hacia la dirección en que se quiere hacer el desplazamiento. Debe estar lista toda la maquinaria necesaria para hacer el movimiento y arrancar en cuanto éste empieza, como sucede con un corredor de carreras, que está completamente listo en la línea de salida para arrancar en cuanto le den la señal. Así pasa con un músculo, una célula no muscular, cuya maquinaria está presta para moverse.
Desde el siglo XVIII, los biólogos que habían observado el movimiento
de las amibas también habían descrito transiciones en la consistencia del citoplasma,
que denominaron gel-sol, ya que correspondía al estado más rígido (gel) o líquido
(sol) que éste presentaba, particularmente en los pseudópodos. En algún momento
se pensó que la formación de los pseudópodos y el desplazamiento de la célula
en una dirección se podría deber a los mismos fenómenos de interacción de filamentos
de actina y miosina que hacen que se contraiga un sarcómero. Sin embargo, por
lo que se conoce en la actualidad, parecería que el mecanismo del movimiento
amiboideo reside principalmente en la organización de la actina en el citoplasma
cortical o ectoplasma (Figura V.11). Esta banda de citoplasma periférico, localizado
justamente debajo de la membrana celular, es particularmente transparente y
sufre cambios notorios en su consistencia precisamente cuando se forma un pseudópodo.
Cuando se encuentra en un estado gelatinoso rígido es capaz de soportar grandes
presiones. Al cambiar a la condición líquida, este citoplasma cortical se expande
hacia donde se está desplazando la célula.
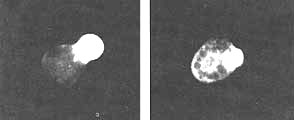
Figura V. 11. Localización de actina en el pseudópodo anterior de dos amibas
en movimiento. Se pudo observar la actina en el citoplasma al decorarla con
anticuerpos preparados contra la proteína y, después, viendo la célula con un
microscopio de fluorescencia.
En 1976 se descubrió que tanto la actina como la miosina se localizan en el
ectoplasma de las células amiboides. La actina de esta región puede ensamblarse
en filamentos largos concomitantemente con un aumento en la viscosidad del citoplasma.
La viscosidad disminuye silos filamentos de actina se rompen en sus componentes,
es decir, si se despolimerizan. Unos años después se pudieron hacer experimentos
de gelificación de extractos citoplásmicos en un tubo de ensayo. Estos extractos
tomados de varios tipos de células se transforman en gel al quitar del medio
iones de Ca2+ y son particularmente ricos en actina, la cual polimerizarse,
forma una red que le da cohesión al gel a pesar de que su masa mayoritaria es
fluida. Si uno toma filamentos de actina y los polimeriza en un tubo de ensayo,
los filamentos tienden a agruparse en haces, por lo que se pensó que el arreglo
reticular observado en los geles citoplásmicos podría resultar de la interacción
de la actina con otras proteínas en el gel, ya que por experimentos de tipo
bioquímico se sabía que los componentes proteicos en estos geles eran de varios
tipos. La primera proteína que se identificó como promotora de la gelación de
actina se aisló de macrófagos y se llamo ABP (por actin-binding
protein). La ABP se une en ángulo recto a los filamentos de
actina, como si fuera una bisagra o un gozne que une dos filamentos en forma
más o menos perpendicular para formar una red octagonal. La presencia de esta
red en el citoplasma cortical impide el libre paso de organelos subcelulares
a esa región, regulando a la vez la comunicación con la membrana celular.
La consistencia del ectoplasma dependerá de la concentración y número del filamentos de actina y de la concentración de las proteínas que, al unirse a los filamentos, causan su interacción para formar la red. La miosina que se encuentra en esta región podría estar interaccionando con los filamentos de actina, lo cual sería responsable de la locomoción. Sin embargo, hay evidencia experimental reciente de que, por un lado, la concentración de miosina en células no musculares es muy baja para formar una estructura tipo sarcómero, que tampoco se ha visto en el citoplasma de este tipo de células, y por el otro, éstas se mueven normalmente. Por este tipo de resultados, y con el descubrimiento de otras proteínas que se unen a la actina, se ha pensado que la locomoción de las células es un fenómeno causado por cambios en la conformación de la actina, más que una contracción causada por su deslizamiento sobre filamentos de miosina. Sin embargo, ésta puede participar en la restricción del ectoplasma a una zona, contrayendo la región inmediatamente por detrás de donde se forma el pseudópodo.
En el modelo de movimiento amiboideo, causado por expansión cortical, el desensamble
de filamentos de actina en el ectoplasma causaría un aumento local en la concentración
de partículas que generaría el movimiento de fluidos hacia esta zona y, por
lo tanto, cambios en la presión osmótica. De esta presión se podría derivar
la fuerza para formar un pseudópodo que se proyectaría hacia el exterior en
aquella zona más fluida del ectoplasma que perdió rigidez al desensamblarse
los filamentos de actina. La formación del pseudópodo y la fuerza del líquido
en la misma dirección moverían a la célula ayudados por la polimerización de
la actina en el pseudópodo para darle rigidez. La repetición de ciclos de polimerización-despolimerización
de la actina en la región cortical le permite a la célula formar pseudópodos
y moverse (Figura V.12). Para la iniciación de cada uno de los ciclos se requiere
de ayuda adicional —otras proteínas— que facilite la polimerización
y despolimerización de la actina en los momentos necesarios. Una proteína con
estas características y que se encuentra tanto en macrófagos como en muchas
otras células es la llamada gelsolina. Esta proteína se pega a los filamentos
de actina y los corta en pequeños fragmentos y monómeros de la proteína que
quedan listos para polimerizarse de nuevo. Sin embargo, como se requiere que
permanezcan despolimerizados durante el estado del sol del citoplasma, la gelsolina
bloquea la polimerización pues permanece pegada al extremo de los fragmentos,
que es por donde podría reiniciarse. Mientras tanto, los monómeros también son
bloqueados al unírseles la proteína llamada profilina. El material para rehacer
la red queda en reserva e inactivo. Cuando se recibe una señal para polimerizar
la actina, el material se activa y se inicia la gelificación.
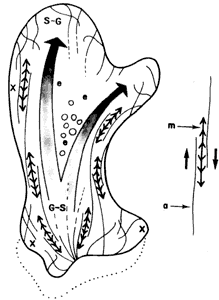
Figura V. 12. Diagrama del movimiento amiboideo. Los filamentos de actina
(a) y miosina (m) interaccionan para permitir el desplazamiento de la célula
sobre el sustrato y la formación y retracción de los pseudópodos. En S- G se
da la transición sol a gel y en G- S a la inversa; e = región del endoplasma;
X región del ectoplasma.
La coordinación de todos estos procesos está bajo el control de señales que
llegan a la membrana de la célula. Al pasar la señal al interior de la célula
se producen varios efectos; uno de los más frecuentes es la salida de iones
de Ca2+ del interior de las vesículas en donde está almacenado. El
Ca2+ es un activador de la gelsolina, a la cual se une. La gelsolina
activada se pega a 1os filamentos de actina y, al fragmentarlos, inicia el ciclo.
Los fragmentos de filamentos unidos a la gelsolina, así como los monómeros unidos
a la profilina, se difunden hacia la membrana celular, en donde se ha encontrado
que se ponen en contacto con lípidos de la clase del fosfoinositol. Estos fosfolípidos
liberan la unión que existe entre la gelsolina y los filamentos de actina, por
un lado, y la asociación de la profilina con monómeros de actina, por el otro,
de modo que estos últimos ya libres, pueden volverse a reunir para formar núcleos
de polimerización y nuevos filamentos de actina. Con ello se recupera el arreglo
reticular que estabiliza al pseudópodo y a la franja cortical gelificada del
ectoplasma (Figura V.13). Aunque éste sólo es un modelo, hay mucha evidencia
experimental que nos hace pensar que es el mecanismo responsable de ellas transiciones
gel-sol del citoplasma y de la locomoción celular. Nuevamente, en este modelo
la miosina podría participar asociada a la actina en algún tipo de contracción
que actúe en concierto con los cambios de consistencia descritos.
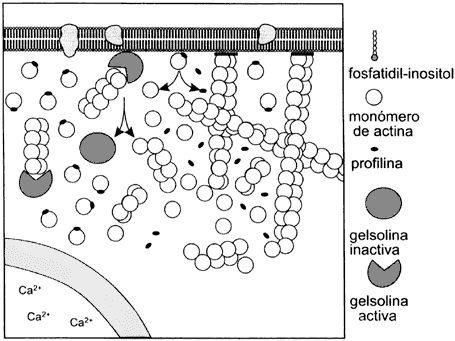
Figura V. 13. Diagrama del proceso de polimerización y despolimerización de la actina en la región cortical de una célula en movimiento. Este proceso ayuda a la expansión del citoplasma para formar un pseudópodo. Las proteínas que interaccionan con la actina y su unión a fosfolípidos en la membrana regulan la polimerización y despolimerización de la actina en conjunto con el Ca2+ en el citoplasma.